2025年3月,生物活性分子与成药性优化全国重点实验室黄深明研究员在Nature杂志上发表了题为“Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis”的研究论文。该研究首次鉴定出神经酰胺(ceramide)的内源性受体CYSLTR2和P2RY6,系统揭示了神经酰胺通过激活这些受体加重动脉粥样硬化的分子机制。研究发现,在慢性肾病(CKD)患者中,血浆神经酰胺水平升高与冠状动脉疾病的严重程度呈正相关,靶向该通路能够有效缓解慢性肾病相关的动脉粥样硬化病变。此外,研究还通过解析神经酰胺与受体复合物的高分辨率结构,揭示了受体如何选择性识别神经酰胺的作用机制。该研究为动脉粥样硬化及相关心血管疾病的防治提供了新策略。

动脉粥样硬化是心梗、脑卒中等心血管疾病的主要病理基础,当前以他汀类药物为主的降脂治疗仅能降低约三分之一的心血管事件发生风险,“残余风险”居高不下,尤其在慢性肾病(CKD)患者中更为突出。近年来,循环中的长链神经酰胺(如C16:0)被证实可独立于胆固醇预测心血管风险,被称为“第二胆固醇”,但其致病机制一直未能明确。
该研究通过系统性筛选,发现神经酰胺C16:0可直接激活Gq偶联的GPCR受体—CYSLTR2和P2RY6,进而触发下游炎症小体信号通路,导致动脉粥样硬化斑块加剧。基因敲除或药物抑制这两个受体,可在不影响血脂水平的情况下显著减轻小鼠动脉粥样硬化病变程度。值得注意的是,在慢性肾病合并动脉粥样硬化模型中,受体缺失或拮抗同样表现出显著保护作用。
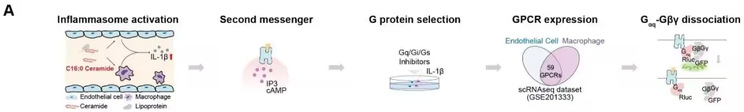
图1 神经酰胺受体的筛选流程
在284例冠心病患者的临床样本研究中,显示随着肾功能下降,患者血浆中多种神经酰胺水平显著上升,且与冠状动脉病变严重程度(Gensini评分)正相关,提示神经酰胺是CKD患者心血管风险的独立预测因子。
在分子机制层面,该研究通过利用冷冻电镜技术解析了“C16:0/C20:0神经酰胺–CYSLTR2–Gq”复合物的三维结构,揭示了神经酰胺结合受体并激活G蛋白的精细构象变化和分子机制,为靶向该通路的药物设计提供了结构基础。
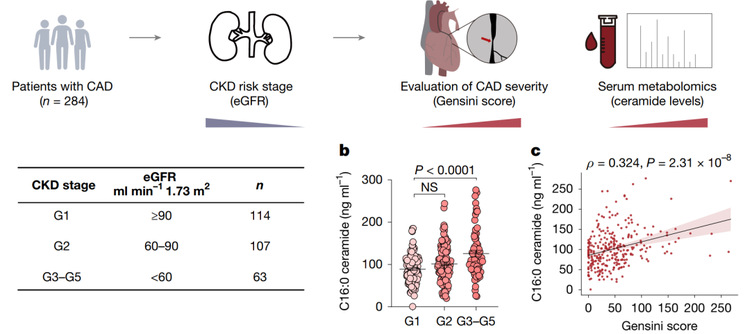
图2 神经酰胺与CKD患者心血管风险相关
该研究不仅揭示了神经酰胺致病的新机制,突破了当前降脂治疗的瓶颈,也为动脉粥样硬化及相关疾病的精准防治开辟了新方向。未来,针对CYSLTR2和P2RY6的抑制剂或抗体药物,以及基于神经酰胺谱和受体多态性的风险分层策略,有望成为应对心血管“残余风险”的新手段。
黄深明研究员是该研究论文的共同第一作者,暨南大学生物活性分子与成药性优化全国重点实验室为作者署名单位。
论文链接:https://doi.org/10.1038/s41586-025-08792-8


