生物活性分子与成药性优化全国重点实验室黄深明研究员继在Nature发表膜受体药理学研究论文“Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis”后(Nature, 2025, 641, 476-485),最近在Cell再次发表相关研究论文“Elucidating pathway-selective biased CCKBR agonism for Alzheimer's disease treatment”。该论文系统阐明了胆囊收缩素受体(CCKBR)下游不同G蛋白信号在阿尔茨海默病(AD)中的功能差异,并提出通路选择性干预策略。
AD以记忆衰退与认知障碍为特征,全球负担持续上升。胆囊收缩素(CCK)是脑内含量最丰富的神经肽之一,通过与CCKBR特异性结合调控情绪、学习记忆、焦虑与恐惧等高级脑功能;外源补充CCK8s可显著改善老年大鼠的空间学习记忆,提示CCK信号通路具备治疗AD的潜力。然而,CCK存在多种亚型并能激活Gs、Gq、Gi等多条通路,如何实现对CCKBR的选择性调控仍是关键科学问题,靶向CCKBR是否能开发治疗AD的药物亟需探索。
该研究从临床提出问题,收集了78例不同认知能力分期的AD患者的脑脊液样本,发现重度痴呆患者的脑脊液多肽成分对CCKBR的Gq信号激活能力显著低于轻度痴呆患者,对Gi信号的激活能力高于轻度痴呆患者。这说明CCKBR的Gq信号活力随着AD病程的加重而逐渐减弱,而Gi信号活力则相反。此外,团队也在动物模型中揭示了CCKBR下游不同G蛋白信号通路在AD进程中的功能。研究团队进一步通过解析内源性激动剂CCK8s激活CCKBR不同G蛋白(Gs、Gq、Gi)的分子机制,发现CCK8s在受体口袋中通过与不同区域的残基相互作用引导特异性G蛋白偶联,顶部、中部和底部分别主要引导受体的Gs、Gq、Gi信号传导,揭示了CCKBR信号偏向性的分子生物学基础。基于该基础,研究团队先后开发了Gi偏向性的多肽激动剂Lyz-866、小分子激动剂z-44以及Gq偏向性激动剂3r1,其中z-44完全丧失Gq/Gs活性,保留Gi信号,而3r1通过在Lyz-866的基础上通过DL-正亮氨酸替换甲硫氨酸显著提升了其激活CCKBR-Gq信号的能力。更重要的是,相较于内源性配体CCK8s,设计开发的Lyz-866、z-44以及3r1具备良好的血脑屏障穿透性和更长的半衰期。
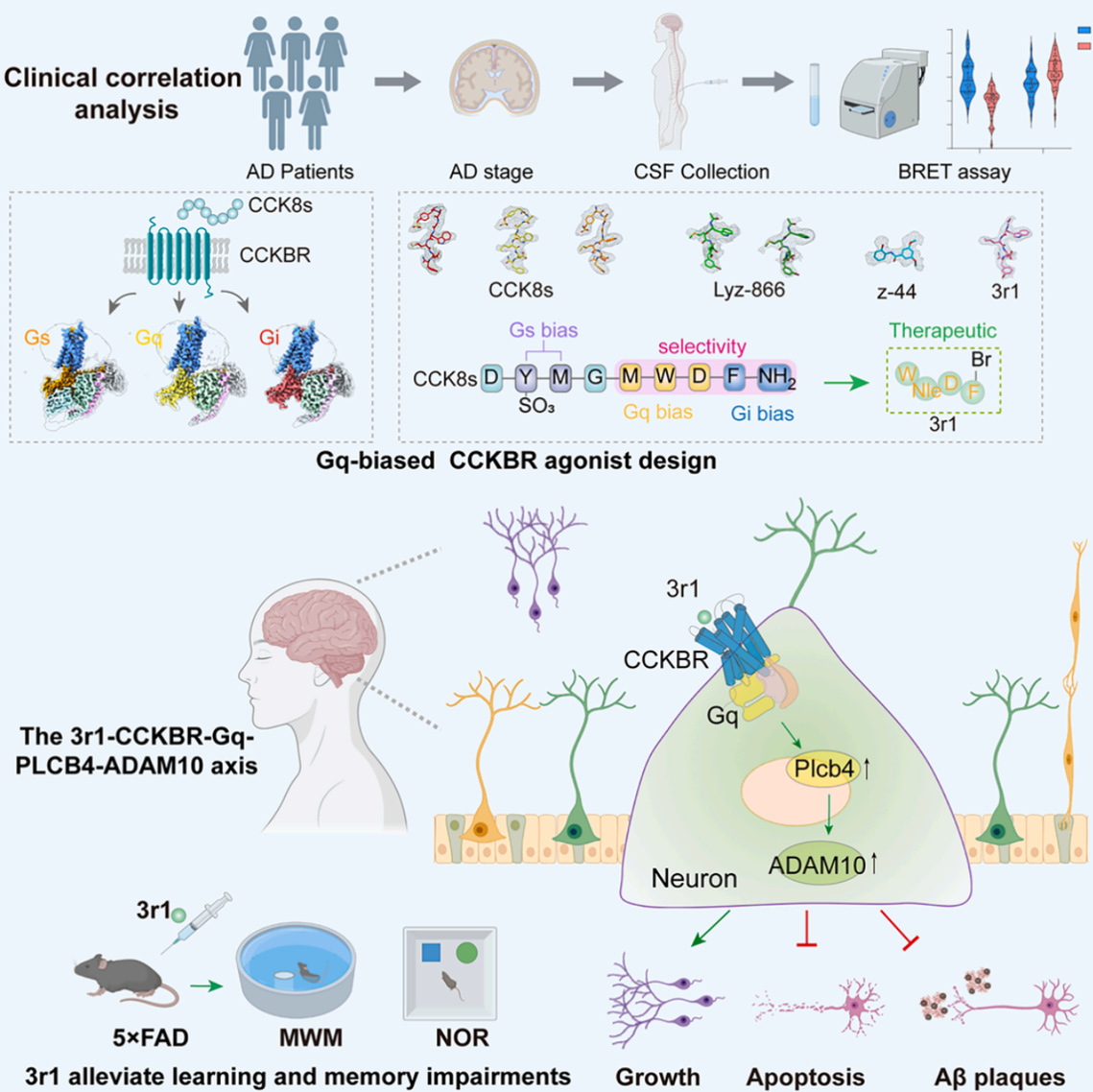
研究团队发现Gq偏好性CCKBR激动剂3r1治疗后显著改善小鼠的空间学习与记忆能力,并促进海马长时程增强(LTP),减少Aβ斑块沉积和Tau蛋白磷酸化。通过动物模型与转录组进一步阐明了PLCB4与ADAM10之间的调控关系,发现3r1对ADAM10的上调作用依赖于Gq信号和PLCB4的激活,揭示了一条全新的CCKBR-Gq-PLCB4-ADAM10信号轴,阐明了3r1通过激活此通路,协同促进非淀粉样蛋白途径的APP加工、实现神经保护的分子机制。以上研究为靶向CCKBR发展AD的新型干预治疗策略提供了依据。黄深明研究员是该研究论文的共同第一作者,暨南大学生物活性分子与成药性优化全国重点实验室为作者署名单位。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(25)01238-3


